Zum vierten Mal hat die TK den Innovationsreport unterstützt, der gestern am 7. September in Berlin vorgestellt wurde. Er wird herausgegeben von Professor Dr. Gerd Glaeske, Professor Dr. Wolf-Dieter Ludwig und Professor Dr. Petra Thürmann. Die Autoren bieten in dem Report eine strukturierte Übersicht über die neuen Arzneimittel des Jahres 2013. Der zeitliche Abstand zu den Markteinführungen erlaubt eine fundierte Bewertung. Diese beinhaltet vor allem:
 Von links: Prof. Dr. Gerd Glaeske (SOCIUM, Universität Bremen), Prof. Dr. Petra Thürmann (HELIOS Klinikum Wuppertal), Dr. Jens Baas (Vorstandsvorsitzender Techniker Krankenkasse) und Prof. Dr. Wolf-Dieter Ludwig (Vorsitzender des Vorstands der Arzneimittelkommission der deutschen Ärzteschaft).
Von links: Prof. Dr. Gerd Glaeske (SOCIUM, Universität Bremen), Prof. Dr. Petra Thürmann (HELIOS Klinikum Wuppertal), Dr. Jens Baas (Vorstandsvorsitzender Techniker Krankenkasse) und Prof. Dr. Wolf-Dieter Ludwig (Vorsitzender des Vorstands der Arzneimittelkommission der deutschen Ärzteschaft).
- die frühe Nutzenbewertung des Gemeinsamen Bundesausschuss (G-BA),
- sogenannte „Rote-Hand-Briefe“, mit denen Ärzte und Apotheker vor Nebenwirkungen gewarnt werden, die bei der Zulassung noch nicht bekannt waren,
- Marktrücknahmen,
- weitere Studien und Bewertungen anderer Autoren.
Jedes Arzneimittel wird zudem in drei Kategorien bewertet: Bereits verfügbare Therapien, (Zusatz-)Nutzen für die Patienten sowie Kosten. Am Ende wird jedes Präparat mit einer Gesamtpunktzahl bewertet und das Ergebnis mit einer Ampel dargestellt.
Nur eine Ampel zeigt „grün“
Von den 23 bewerteten Präparaten wurde leider nur eines mit einer grünen „Gesamtampel“ bewertet. Für neun Präparate zeigte die Gesamtampel „gelb“ und für 13 „rot“. Damit sind die neuen Arzneimittel im Jahr 2013 ähnlich bewertet worden, wie die des Jahres 2012. Erstaunlich ist aber, dass der durchschnittliche Preis für eine Packung eines neuen Medikamentes aus 2013 im Jahr nach seiner Markteinführung doppelt so hoch ist, wie der für ein neues Medikament aus 2012 (1.418 € gegenüber 670 €). Auffällig ist auch, dass fünf der 23 Präparate nicht mehr auf dem deutschen Markt sind. Ein weiteres Medikament nicht mehr in allen Wirkstärken.
AMNOG soll Qualität fördern und Kosten dämpfen
Eigentlich hatte die Bundesregierung mit dem etwas sperrig klingenden Arzneimittelmarktneuordnungsgesetz (AMNOG) verhindern wollen, dass neue Medikamente zu überteuerten Preisen in Deutschland auf den Markt kommen, wenn sie lediglich genauso gut sind wie bewährte Präparate. Es sollte die Qualität und die Wirtschaftlichkeit der Versorgung in Deutschland erhöhen und tatsächlich: Seit dem 1.1.2011 dürfen die Pharmakonzerne nicht mehr jeden beliebigen Preis für neue Medikamente festlegen. Gemeinsam mit dem Spitzenverband der Krankenkassen wird dieser nun ausgehandelt – Basis dafür bildet die frühe Nutzenbewertung des G-BA, welcher sich neue Medikamente in einem reglementierten Verfahren nach ihrem Mehrwert für die Patienten ansieht.
Leider konnten bis jetzt nicht alle Ziele erreicht werden. Die Einsparungen blieben weit hinter den Erwartungen zurück und die Industrie nutzte Schlupflöcher, um einem fairen Preis zu entgehen. Die Unternehmen brachten zum Beispiel Medikamente zu hohen Preisen auf den deutschen Markt und nahmen sie dann wieder zurück, als sie nicht den erwarteten Preis dafür bekamen. Im ersten Jahr nach Markteinführung darf der Preis nämlich weiterhin durch den Hersteller frei festgelegt werden. Patienten und Ärzte hatten bei den Rücknahmen oft das Nachsehen. Hinzu kommt, dass Medikamente häufig an Patienten verschrieben werden, für die sie gar keinen Zusatznutzen haben. Aufgrund dieser Praxis hört man oft die Forderung, dass das AMNOG „in der Arztpraxis ankommen muss“.
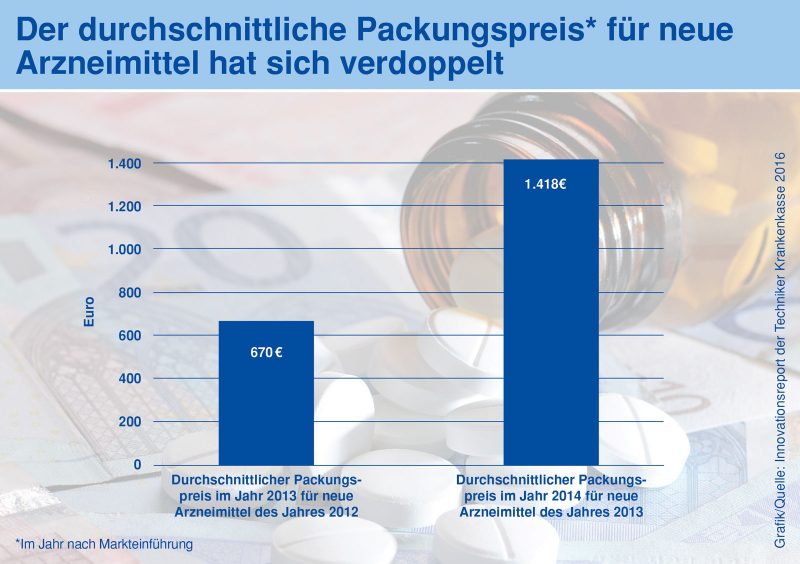 Die Infografik verdeutlicht den Preisanstieg pro Packung eines neuen Medikaments innerhalb eines Jahres.
Die Infografik verdeutlicht den Preisanstieg pro Packung eines neuen Medikaments innerhalb eines Jahres.
Pharmaindustrie will Nutzenbewertung weiter aufweichen
Schon kurz nach dem Inkrafttreten des AMNOG wurde von einem „lernenden System“ gesprochen. Nachdem erste Anpassungen vom Gesetzgeber erfolgt sind, hat die Bundesregierung als politisches Zugeständnis an die Pharmaindustrie einen Dialog begonnen, dessen Abschlusspapier nun vorliegt. Weder die Krankenkassen als Kostenträger, noch die Vertreter der Ärzteschaft, Apotheker oder das Parlament waren an diesem „Pharmadialog“ beteiligt. Kein Wunder also, dass sich das Ergebnis wie eine Wunschliste der Industrie liest. Dabei droht die Qualität hinter den wirtschaftlichen Interessen der Industrie zurückzufallen. Problematisch ist dabei, dass ein wichtiger Grundsatz des AMNOG aufgeweicht werden soll. Er lautet: Für ein neues Arzneimittel zahlen die Kassen nur dann mehr, wenn es auch besser als die bestehenden ist.
Zudem ist geplant, dass Ärzte demnächst in ihrer Praxissoftware darüber informiert werden sollen, ob ein Medikament, das sie verschreiben möchten, einen Zusatznutzen hat oder nicht. Eine lange bestehende Forderung aller Beteiligten würde damit erfüllt und das AMNOG würde tatsächlich in der Arztpraxis ankommen. Aber auch hier hält sich die Industrie eine Hintertür offen. Denn es ist vorgesehen, dass die Pharmaunternehmen dabei mitreden dürfen, wie die Information in der Software aufbereitet und dargestellt wird. Schon melden sich erste Stimmen, die meinen, dass nicht nur das Ergebnis der frühen Nutzenbewertung dargestellt werden sollte und die Darstellung von „Zusatznutzen“ oder „kein Zusatznutzen“ zu vereinfacht wäre. Erhält die Industrie hier ein Mitspracherecht – ausgerechnet an der sensiblen Schnittstelle zwischen unabhängigem G-BA und der Ärzteschaft – wäre das so, als wenn die Schüler in Zukunft selbst bestimmen, nach welchen Regeln ihre Lehrer die Noten vergeben.
Als Instrument der Kostendämpfung wird eine geplante Umsatzschwelle von 250 Millionen Euro genannt: Im ersten Jahr nach Markteinführung eines Medikaments soll der Pharmaunternehmer bis maximal zu dieser Summe seinen frei festgelegten Preis erhalten. Wird diese Schwelle überschritten, soll der verhandelte Preis rückwirkend ab Erreichen der Schwelle gelten. Diese Regelung ist jedoch genauso unlogisch, wie die der freien Preisgestaltung im ersten Jahr. Die Idee des AMNOG basiert darauf, dass die Kassen die Höhe des Preises auf Basis des Zusatznutzens verhandeln. Weitere Zugeständnisse an die Industrie sind auch unter Qualitätsaspekten nicht sinnvoll. Denn sie garantieren den Unternehmen einen hohen Preis, auch wenn das Ergebnis der Nutzenbewertung lautet: kein Zusatznutzen. Bis dahin kann es aber sein, dass schon bis zu einer Viertelmilliarde Euro an den Hersteller überwiesen wurde. Aus fachlicher Sicht muss der verhandelte Preis demnach rückwirkend ab der Markteinführung gelten.
Die nun geplanten Instrumente sind also weitgehend ungeeignet, um die Arzneimittelversorgung in den nächsten Jahren nachhaltig zu gestalten. Dafür müssten vielmehr die folgenden Punkte berücksichtigt werden:
- Weiterhin nur mehr für neue Medikamente bezahlen, wenn sie auch besser sind
- Nutzenbewertung nicht weiter aufweichen
- Umsatzschwelle ist fachlich nicht sinnvoll
- Industrie darf kein Einfluss auf das Arztinformationssystem nehmen
- Vertraulichkeit des Erstattungsbetrags in Ausnahmefällen einführen
Ein ebenso komplexes wie spannendes Thema. Übersicht: Alle Innovationsreporte seit 2013
Im Video: Eindrücke von der PK zum Innovationsreport in Berlin am 7.9. sowie Statements der Podiums-Teilnehmer.
https://youtu.be/otfiyiRdb_E
![]()